Chun b tht tt kin thc cho bài kim tra hc k 2 môn hóa cùng VUIHOC trong cng Ôn thi hc kì 2 lp 12 môn hóa chi tit. Mi các em cùng theo dõi bài vit di ây.

1. Ôn thi hc kì 2 lp 12 môn hóa: i cng v kim loi
1.1 Nguyên tc iu ch kim loi
Nguyên tc: Kh ion kim loi thành nguyên t
Mn+ + ne  M
M
1.2 Phng pháp iu ch kim loi
a. Phng pháp nhit luyn:
- Dùng iu ch các kim loi sau Al, s dng các cht kh mnh nh C, CO, H2 hoc Al kh các ion kim loi trong oxit nhit cao.
b. Phng pháp thy luyn:
- Dùng iu ch các kim loi sau Al. Dùng kim loi có tính kh mnh hn kh ion kim loi trong dung dch mui.
c. Phng pháp in phân
- in phân nóng chy: iu ch nhng kim loi có tính kh mnh nh K, Na, Ca, Mg, Al...
in phân nóng chy các hp cht (mui, oxit, bazo) ca chúng:
2NaCl ![large xrightarrow[]{dpnc}](https://lh7-us.googleusercontent.com/KMmVZRrgwq4Q5UMDUt7-aGTuuhAZT2pMjhrCbElUTfgjakYiD47lX8dBOEl_myT4hAv_WQhH3sV7HvYfluPTa1SAD01s8DwbWp7uOWZ7MPY9uFcVlmEjFz2e4QDrcotOhfbh1nQkDqZ9RGPlcPA4IJ0) 2Na + Cl2
2Na + Cl2
MgCl2 ![large xrightarrow[]{dpnc}](https://lh7-us.googleusercontent.com/9phW0bTrSC0DC7rWBwY8IO9fOub6vYXBvvZpqSk_bEB_xALDUroQnI5GaXtk78i4nQr83rIB3jE_fdfiHO6SRnB9Cpg4bEMsOIhmbyyNhYm1BeXzjBgoHkelwK8gfpT25T9Zn3LsbxMTVveWr6jt-7I) Mg + Cl2
Mg + Cl2
2Al2O3 ![large xrightarrow[]{dpnc}](https://lh7-us.googleusercontent.com/tegy0Bhkf7fr2EZmta6_UlDKt0xpMfpNKtuqObFrsvz7H3Dkji7gy9WdNvCahXsdrfa8lWNq8e7eLJf0i75MetnXbhRjkVgd8LqFpoeQccAHrwPDlInccLpP3UKMif0VnMpQUcQw6BFMuG8HgdQMU_Q) 4Al + 3O2
4Al + 3O2
- in phân dung dch: iu ch kim loi phía sau Al.
- Tính lng cht thu c in cc:
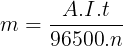
Trong ó:
-
m là khi lng cht thoát ra in cc;
-
A là khi lng mol nguyên t;
-
n là s electron cho hoc nhn;
-
I là cng dòng in;
-
t là thi gian in phân.
2. Ôn thi hc kì 2 lp 12 môn hóa: Kim loi kim, kim th, nhôm
2.1 Kim loi kim
a. V trí:
- Kim loi kim gm Li, Na, K, Rb, Cs, Fr
- Kim loi kim th thuc nhóm IA, cu hình e: ns1
b. Tính cht hóa hc:
- Có tính kh mnh: M  M+ + e
M+ + e
- Tác dng vi phi kim
- Tác dng vi axit (HCl, H2SO4 loãng) to mui và H2
- Tác dng vi nc to dung dch kim và H2: 2R + 2H2O  2ROH + H2
2ROH + H2
c. iu ch:
- in phân nóng chy mui halogen hoc hidroxit ca chúng. iu ch Na bng cách in phân nóng chy NaCl và NaOH
2NaCl ![large xrightarrow[]{dpnc}](https://lh7-us.googleusercontent.com/eHoR0MjsmHcQUv9oEMfJkeFv7YnYaB5xi7GkrAJtl5R5IlIGfqPOgZ_j4CF8NUVqMQ0yrHw68mCLIJLXwc-7sRuhIWAlXG_YpTeeq6ut-hBLyLaxjqRbPMCcNbId2pnaRn3mDvES06jUcTn5qDucdZk) 2Na + Cl2
2Na + Cl2
4NaOH ![large xrightarrow[]{dpnc}](https://lh7-us.googleusercontent.com/ttp_5C-URXuiQO7yDsapgeUgJXPZEh2O825RRTyCt18EpemqF3XQ7h_dmyRgQMOasjhlh4jCMTHyme441EDujVTvirxwN7Zsob_6_iNHLCpcGeyP8LFVKNh5KjRsrDwVSobYD5MZkXy-OYpA7b1YjqE) 4Na + 2H2O + O2
4Na + 2H2O + O2
2.2 Kim loi kim th và hp cht quan trng ca kim loi kim th
a. Kim loi kim th:
- V trí: Thuc nhóm IIA gm các nguyên t sau: beri (Be) , magie (Mg) , canxi (Ca) , stronti (Sr) , bari (Ba). Cu hình electron LNC: ns2
b. Tính cht hóa hc:
Có tính kh mnh (nhng yu hn kim loi kim) M 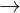 M2+ + 2e
M2+ + 2e
- Tác dng vi phi kim:
- Tác dng vi dung dch axit:
+ Vi axit HCl , H2SO4 loãng: to mui và gii phóng H2
+ Vi axit HNO3 , H2SO4 c: to mui + sn phm kh + H2O
- Tác dng vi nc: nhit thng: Ca , Sr , Ba phn ng to baz và H2.
c. Mt s hp cht quan trng ca canxi
- Canxi hidroxit – Ca(OH)2: (Nc vôi trong, vôi tôi, vôi sa)
+ Tác dng vi axit: Ca(OH)2 + 2HCl 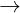 CaCl2 + 2H2O
CaCl2 + 2H2O
+ Tác dng vi oxit axit: Ca(OH)2 + CO2 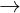 CaCO3↓ + H2O (nhn bit khí CO2 )
CaCO3↓ + H2O (nhn bit khí CO2 )
+ Tác dng vi dung dch mui: Ca(OH)2 + Na2CO3 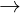 CaCO3 ↓+ 2NaOH
CaCO3 ↓+ 2NaOH
- Canxi cacbonat – CaCO3: (á vôi)
+ Phn ng phân hy: CaCO3 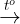 CaO +CO2
CaO +CO2
+ Phn ng vi axit mnh: CaCO3 + 2HCl 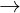 CaCl2 + CO2+ H2O
CaCl2 + CO2+ H2O
+ Phn ng vi nc có CO2: CaCO3 + H2O + CO2 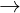 Ca(HCO3)2
Ca(HCO3)2
- Canxi sunfat: (Thch cao)
Thch cao sng: CaSO4.2H2O Thch cao nung: CaSO4.H2O Thch cao khan: CaSO4
d. Nc cng:
- Khái nim: nc có cha nhiu ion Ca2+ và Mg2+ c gi là nc cng.
Phân loi:
-
Tính cng tm thi: gây nên bi các mui Ca(HCO3)2 và Mg(HCO3)2
-
Tính cng vnh cu: gây nên bi các mui CaSO4 , MgSO4 , CaCl2 , MgCl2
-
Tính cng toàn phn: gm c tính cng tm thi và vnh cu.
- Cách làm mm nc cng: Nguyên tc: là làm gim nng các ion Ca2+ và Mg2+ trong nc cng.
+ Phng pháp kt ta:
* i vi nc có tính cng tm thi:
-
un sôi, lc b kt ta: Ca(HCO3)2 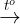 CaCO3 ↓ + CO2 ↑ + H2O
CaCO3 ↓ + CO2 ↑ + H2O
-
Dùng Ca(OH)2 , lc b kt ta: Ca(HCO3)2 + Ca(OH)2 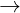 2CaCO3↓ + 2H2O
2CaCO3↓ + 2H2O
-
Dùng Na2CO3 ( hoc Na3PO4): Ca(HCO3)2 + Na2CO3 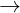 CaCO3 ↓ + 2NaHCO3
CaCO3 ↓ + 2NaHCO3
* i vi nc có tính cng vnh cu và toàn phn: dùng Na2CO3 (hoc Na3PO4)
CaSO4 + Na2CO3 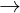 CaCO3↓ + Na2SO4
CaCO3↓ + Na2SO4
+ Phng pháp trao i ion: làm mm c mi loi nc cng
- Nhn bit ion Ca2+ và Mg2+ trong dung dch: Thuc th: dung dch ca 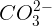 (nh Na2CO3 …)
(nh Na2CO3 …)
2.3 Nhôm và hp cht ca nhôm
a. V trí: Nhóm IIIA , chu kì 3 , ô th 13.
Cu hình electron: Al (Z=13): 1s22s22p63s23p1 hay [Ne]3s23p1 Al3+: 1s22s22p6
b. Tính cht hóa hc: Có tính kh mnh (yu hn kim loi kim, kim th) Al 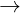 Al3+ + 3e
Al3+ + 3e
- Tác dng vi phi kim:
- Tác dng vi axit:
+ Vi axit HCl , H2SO4 loãng: to mui và gii phóng H2
+ Vi axit HNO3 , H2SO4 c: to mui + sn phm kh + H2O
Chú ý: Al không tác dng vi HNO3 c ngui và H2SO4 c ngui
- Tác dng vi oxit kim loi (phn ng nhit nhôm)
2Al + Fe2O3 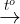 Al2O3 + 2Fe
Al2O3 + 2Fe
- Tác dng vi nc: Nhôm khocirc;ng tác dng vi nc dù nhit cao vì trên b mt ca Al ph kin mt lp Al2O3 rt mng, bn và mn không cho nc và khí thm qua.
- Tác dng vi dung dch kim: 2Al + 2NaOH + 2H2O 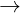 2NaAlO2 + 3H2 ↑
2NaAlO2 + 3H2 ↑
c. Sn xut nhôm
- Nguyên liu: qung boxit (Al2O3.2H2O)
- Phng pháp: in phân nhôm oxit nóng chy 2Al2O3 ![large xrightarrow[]{dpnc}](https://lh7-us.googleusercontent.com/SRcxW4nVt6Nq5ZcIplFaKJEC1FGZp-YuABmx71ABoZJBw3LMgBGuU7aoDkebbsv9DhM7qvBtXZbpux4EafBjv6poCkawkb_npRRKJUS4O3zTNDE7hnsgvzgc_MDmn4HNxDpkRFh3nkSf4IT4QhgPlFc) 4Al + 3O2
4Al + 3O2
>> Nhôm và mt s hp cht ca nhôm
d. Mt s hp cht ca nhôm
- Nhôm oxit – Al2O3 là oxit lng tính
Tác dng vi axit: Al2O3 + 6HCl 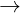 2AlCl3 + 3H2O
2AlCl3 + 3H2O
Tác dng vi dung dch kim: Al2O3 + 2NaOH 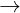 2NaAlO2 + H2O
2NaAlO2 + H2O
- Nhôm hidroxit – Al(OH)3 là hidroxit lng tính.
+ iu ch Al(OH)3 :
AlCl3 + 3NH3 + 3H2O 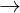 Al(OH)3 ↓ + 3NH4Cl
Al(OH)3 ↓ + 3NH4Cl
Hay: AlCl3 + 3NaOH (va ) 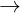 Al(OH)3 + 3NaCl
Al(OH)3 + 3NaCl
- Nhôm sunfat:
Quan trng là phèn chua, công thc: K2SO4.Al2(SO4)3.24H2O hay KAl(SO4)2.12H2O
- Cách nhn bit ion Al3+ trong dung dch:
+ Thuc th: dung dch NaOH d
+ Hin tng: kt ta keo trng xut hin sau ó tan trong NaOH d.
3. Ôn thi hc kì 2 lp 12 môn hóa: St, ngm crom và mt s kim loi khác
3.1 St
a. V trí: St ô th 26, nhóm VIIIB, chu kì 4
Cu hình electron: Fe (Z=26): 1s22s22p63s23p63d64s2 hay [Ar]3d64s2
Fe2+: [Ar]3d6 Fe3+: [Ar]3d5
b. Tính cht vt lý:
- St có tính nhim t khí b nam châm hút.Dn in kém và gim dn: Ag > Cu > Au > Al > Fe.
c. Tính cht hóa hc:
Có tính kh trung bình
Fe 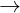 Fe2+ + 2e
Fe2+ + 2e
Fe 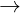 Fe3+ + 3e
Fe3+ + 3e
- Tác dng vi phi kim:
Fe + S 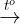 FeS 3Fe + 2O2
FeS 3Fe + 2O2 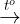 Fe3O4 2Fe + 3Cl2
Fe3O4 2Fe + 3Cl2 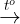 2FeCl3
2FeCl3
- Tác dng vi axit:
Chú ý: Fe không tác dng vi axit HNO3 c ngui và H2SO4 c ngui
- Tác dng vi dung dch mui: Fe kh c ion ca kim loi ng sau nó to mui Fe2+ (tr mui Ag+ d to Fe3+)
Fe + CuSO4 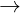 FeSO4 + Cu↓
FeSO4 + Cu↓
c. iu ch:
- Các qung st trong t nhiên: Fe3O4 (manhetic); Fe2O3 (hematic); FeCO3 (xiderit); FeS2 (pirit)
- Phng pháp nhit luyn.
d. Hp cht ca st:
- Hp cht st (II)
+ Tính cht hóa hc c trng ca hp cht st (II) là va kh , va oxi hóa
+ Fe(OH)2 trong không khí: 4Fe(OH)2 + O2 + 2H2O 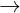 4Fe(OH)3↓
4Fe(OH)3↓
(trng xanh) (nâu )
+ FeO , Fe(OH)2 có tính bazo khi tác dng vi HCl hay H2SO4 loãng to mui st (II)
FeO + 2HCl 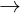 FeCl2 + H2
FeCl2 + H2
Fe(OH)2 + 2HCl 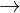 FeCl2 + 2H2O
FeCl2 + 2H2O
- Hp cht st (III):
+ Hp cht st (III) có tính oxi hóa.
+ Fe(OH)3 kém bn nhit: 2Fe(OH)3 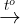 Fe2O3 + 3H2O
Fe2O3 + 3H2O
+ Fe2O3 , Fe(OH)3 có tính bazo khi tác dng vi HCl, H2SO4, HNO3 to mui st (III)
Fe2O3 + 6HCl 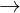 2FeCl3 + 3H2O
2FeCl3 + 3H2O
Fe2O3 + 6HNO3 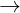 2Fe(NO3)3 + 2H2O
2Fe(NO3)3 + 2H2O
B CO, H2 , Al kh thành Fe nhit cao: Fe2O3 + 3CO 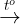 2Fe + 3CO2
2Fe + 3CO2
iu ch: phân hy Fe(OH)3 nhit cao.
2Fe(OH)3 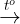 Fe2O3 + 3H2O
Fe2O3 + 3H2O
3.2 Hp kim ca st
a. Gang
- Khái nim: là hp kim ca Fe vi C (2-5%), ngoài ra còn mt lng nh Si, Mn, S,...
- Phân loi:
+ Gang trng: cha ít C. Si, rt cng, dùng luyn thép
+ Gang xám: cha nhiu C, Si, kém cng, dùng úc các b phn máy móc, ng dn
nc, cánh ca,....
- Nguyên tc sn xut gang: kh oxit st bng than cc (CO) trong lò cao
- Nguyên liu sn xut gang: Qung st, than cc, cht chy (CaCO3, SiO2)
b. Thép
- Khái nim: là hp kim ca Fe vi C (0,01-2%), ngoài ra còn mt lng nh Si, Mn, Cr, Ni...
- Phân loi:
+ Thép thng (thép cacbon): cha ít C,Si,Mn và rt ít S,P
+ Thép c bit: là thép có thêm mt s các nguyên t: Si, Mn, Cr, Ni, W, V
- Nguyên tc sn xut thép: Làm gim hàm lng các tp cht (C, S, Si, Mn,..) có trong gang bng cách oxi hoá các tp cht ó thành oxit ri bin thành x và tách ra khi thép
- Nguyên liu sn xut thép: Gang.
3.3 Crom và hp cht crom
a. Crom
Crom: tính kh (Zn > C r> Fe)
+ Tác dng vi phi kim ( nhit cao) Cr 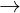 Cr3+ + 3e
Cr3+ + 3e
+ Tác dng vi dung dch axit (khi un nóng và không có KK) Cr 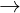 Cr+2 + 2e
Cr+2 + 2e
Crom b th ng i vi các axit HNO3 c, ngui và H2SO4 c, ngui
+ Crom bn vi nc và không khí do có màng oxit bn vng bo v
b. Hp cht crom
+ Cr2O3: là oxit lng tính, tan trong dung dch axit và kim c
+ Cr(OH)3: là hiroxit lng tính tan trong dung dch axit và kim
Cr(OH)3 + 3H+ 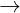 Cr3+ + 3H2O
Cr3+ + 3H2O
Cr(OH)3 + OH- 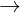 CrO + 2H2O
CrO + 2H2O
+ Cr3+:
2CrO + 3Br2 + 8OH- 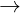 2CrO + 6Br- + 4H2O
2CrO + 6Br- + 4H2O
+ CrO3 :
2CrO3 + H2O 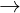 H2Cr2O7
H2Cr2O7
-
Có tính oxi hóa mnh, mt s cht vô c và hu c nh S, P, C, C2H5OH, NH3... bc cháy khi tip xúc vi CrO3 : 2CrO3 + 2NH3 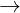 Cr2O3 + N2 + 3H2O
Cr2O3 + N2 + 3H2O
+ CrO, Cr2O:
Cr2O + H2O 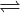 2CrO42- + 2H+
2CrO42- + 2H+
(da cam) (vàng)
Cr2O72- + 6Fe2+ + 14H+ 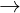 2Cr3+ + 6Fe3+ + 7H2O
2Cr3+ + 6Fe3+ + 7H2O
4. Ôn thi hc kì 2 lp 11 môn hóa: Mt s dng bài tp vn dng
Bài 1: Chia m gam hn hp X gm K và Al thành hai phn bng nhau.
- Cho phn mt vào mt lng d H2O, thu c 0,448 lít khí H2.
- Cho phn hai vào dung dch KOH d, thu c 0,784 lít khí H2.
Bit các khí u o iu kin tiêu chun. Tính m.
Li gii:
Gi s mol ca K, Al ln lt là x, y (trong 1 phn)
Phn 1: 2K + 2H2O 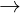 2KOH + H2
2KOH + H2
(mol) x x 0,5x
2KOH + 2Al + 2H2O 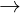 2KAlO2 + 3H2
2KAlO2 + 3H2
(mol) x 1,5x
=> 2x = 0,02 => x = 0,01 (1)
Phn 2: 2K + 2H2O  2KOH + H2
2KOH + H2
(mol) x x 0,5x
2KOH + 2Al + 2H2O 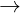 2KAlO2 + 3H2
2KAlO2 + 3H2
(mol) y 1,5y
=>0,5x + 1,5y = 0,035 (2) T (1) và (2) 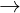 y = 0,02
y = 0,02
Trong hn hp X: m = 2.(0,01.39 + 0,02.27) = 1,86 (gam)
Bài 2: Tin hành 2 thí nghim sau:
Thí nghim 1: Sc khí CO2 t t n d vào dung dch Ca(OH)2.
Thí nghim 2: Cho dung dch NaOH t t n d vào dung dch AlCl3.
Vit phng trình hóa hc ca các phn ng xy ra trong 2 thí nghim trên.
Li gii:
Thí nghim 1: Các phn ng xy ra ln lt
Ca(OH)2 + CO2  CaCO3 + H2O
CaCO3 + H2O
CaCO3 + CO2 + H2O 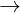 Ca(HCO3)2
Ca(HCO3)2
Thí nghim 2: Xy ra phn ng
AlCl3 + 3NaOH 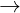 Al(OH)3 + 3NaCl
Al(OH)3 + 3NaCl
Al(OH)3 + NaOH  NaAlO2 + 2H2O
NaAlO2 + 2H2O
Bài 3: Vit phng trình hóa hc các phn ng trong s chuyn hóa sau:
X  Fe
Fe  Y
Y  Fe(OH)3
Fe(OH)3  X
X
Li gii:
Fe2O3 + 3CO  2Fe + 3CO2 (X)
2Fe + 3CO2 (X)
2Fe + 3Cl2  2FeCl3 (Y)
2FeCl3 (Y)
FeCl3 + 3NaOH  Fe(OH)3 + 3NaCl
Fe(OH)3 + 3NaCl
2Fe(OH)3 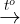 Fe2O3 + 2H2O.
Fe2O3 + 2H2O.
Bài 4: Hòa tan 1,12 gam Fe bng 300 ml dung dch HCl 0,2M, thu c dung dch X và khí H2. Cho dung dch AgNO3 d vào X, thu c khí NO (sn phm kh duy nht ca N+5) và m gam kt ta. Bit các phn ng xy ra hoàn toàn. Tínhm.
Li gii:
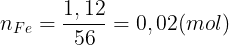
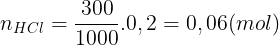
Fe + 2HCl 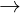 FeCl2 + H2 (1)
FeCl2 + H2 (1)
Ag+ + Cl-  AgCl↓ (2)
AgCl↓ (2)
3Fe2+ + 4H+ + NO3-  3Fe3+ + NO↑ + 2H2O (3)
3Fe3+ + NO↑ + 2H2O (3)
Fe2+ + Ag+  Fe3+ + Ag ↓ (4)
Fe3+ + Ag ↓ (4)
Theo (1)  Dung dch X cha:
Dung dch X cha:
FeCl2 0,02 mol; HCl (0,06 - 0,04) = 0,02 mol
=> X: Fe2+ 0,02 mol; H+ 0,02 mol; Cl- 0,06 mol;
Theo (2)  AgCl ↓ 0,06 mol; Theo (3)
AgCl ↓ 0,06 mol; Theo (3)  Fe2+ còn d: 0,02 - 0,015 = 0,005 (mol)
Fe2+ còn d: 0,02 - 0,015 = 0,005 (mol)
Theo (4)  Ag ↓ 0,005 (mol) Kt ta gm: AgCl 0,06 mol; Ag 0,005 mol. Kt ta có khi lng là:
Ag ↓ 0,005 (mol) Kt ta gm: AgCl 0,06 mol; Ag 0,005 mol. Kt ta có khi lng là:
0,06.143,5 + 0,005.108 = 9,15 (g)
Bài 5: Vit phng trình hóa hc thc hin các chuyn hóa sau (ghi rõ iu kin nu có):
Al2O2  AlCl3
AlCl3  NaCl
NaCl  NaOH
NaOH  CaCO3
CaCO3
Li gii:
a) Al2O2 + 6HCl  2AlCl3 + 3H2O
2AlCl3 + 3H2O
(b) AlCl3 + 3NaOH  Al(OH)3 + 3NaCl
Al(OH)3 + 3NaCl
(c) 2NaCl + 2H2O 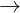 2NaOH + H2 + Cl2
2NaOH + H2 + Cl2
(d) 2NaOH + Ca(HCO3)2 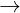 CaCO3 + Na2CO3 + 2H2O
CaCO3 + Na2CO3 + 2H2O
Bài 6: Có 4 dung dch mui ng trong các l mt nhãn riêng bit: AlCl3, NaCl, CrCl3, FeCl3. Ch dùng 1 thuc th hãy nhn bit các dung dch trên.
Li gii:
- Trích mu th cho tng thí nghim
- Cho các mu th tác dng vi NaOH d
+ Mu th nào có kt ta trng keo, sau kt ta tan là AlCl3
+ Mu th nào có kt ta nâu là FeCl3
+ Mu nào có kt ta trng xám là CrCl3
+ Còn li là NaCl
Bài 7: Hòa tan hoàn toàn m gam hn hp X cha FeO, Fe2O3, Fe3O4 và FeCO3 bng dung dch cha HCl (va ) thu c 0,04 mol CO2 và dung dch Y có cha 24,43 gam hn hp mui FeCl3 và FeCl2. Cho NaOH d vào Y trong iu kin không có không khí thy xut hin 16,66 gam kt ta. Tính giá tr ca m?
Li gii:
Y cha FeCl3(a) và FeCl2 (b)
=> 162,5a + 127b = 24,43
m↓ = 107a + 90b = 16,66
=> a = 0,08; b = 0,09
Bo toàn Cl => nHCl = 3a + 2b = 0,42
Bo toàn H => nH2O = 0,21
Bo toàn khi lng: mX + mHCl = m mui + mCO2 + mH2O
=> mX = 14,64 gam.
Bài 8: Nêu hin tng, vit phng trình hóa hc ca phn ng xy ra trong hai thí nghim sau
a. Sc khí CO2 vào dung dch NaAlO2.
b. Cho mt inh st ã ánh b mt vào dung dch FeCl3.
Li gii:
a) Xut hin kt ta màu trng keo
CO2 + H2O + NaAlO2 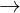 NaHCO3 + Al(OH)3
NaHCO3 + Al(OH)3
b) Dung dch chuyn t màu vàng thành màu xanh nht: Fe + 2FeCl3 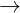 3FeCl2
3FeCl2
Bài 9: Ch dùng mt thuc th, trình bày cách phân bit bn dung dch ng riêng trong các ng nghim: Na2CO3, KCl, AlCl3, FeCl2.
Li gii:
-Trích mu th
-Thuc th: Dung dch Ba(OH)2
+ Có kt ta trng  mu th Na2CO3
mu th Na2CO3
+ Không hin tng  Mu th KCl
Mu th KCl
+ Kt ta trng sau ó tan dn  Mu th AlCl3
Mu th AlCl3
+ Kt ta trng hi xanh  Mu th FeCl2
Mu th FeCl2
Bài 10: Nung 21,6 gam hn hp Mg và Fe trong không khí, thu c 27,2 gam hn hp rn X. Hòa tan ht X cn va 550 ml dung dch HCl 2M, thu c V lít khí H2 (ktc). Tìm V.
Li gii:
Bo toàn khi lng : mO = 27,2 - 21,6 = 5,6 gam
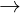 nO = 0,35 mol
nO = 0,35 mol
X + 2HCl 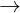 Mui + H2 + H2O
Mui + H2 + H2O
Bo toàn nguyên t H : nH2 = 2nH2 + 2nH2O
<=> 1,1 = 2nH2 + 2 x 0,35 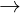 nH2 = 0,2 mol
nH2 = 0,2 mol 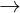 VH2 = 4,48 lít
VH2 = 4,48 lít
Trên ây là toàn b kin thc trng tâm Ôn thi hc kì 2 lp 12 môn hóa. làm tt bài thi hc kì 2 môn hóa bên cnh vic ôn tp lý thuyt thì các em cn luyn tht nhiu dng bài, thi th nm chc cách gii các bài hóa 12. Truy cp vuihoc.vn xem thêm các bài vit khác v kin thc hóa 12 nhé!
Ngun:
https://vuihoc.vn/tin/thpt-de-cuong-on-thi-hoc-k-2-lop-12-mon-hoa-chi-tiet-3553.html
文章定位:





